|
DOCENTE |
Edwin Gutiérrez B |
CORREO |
edwingutierreziedmagdalena@gmail.com |
||
|
ASIGANTURA |
GRADO |
TEMA |
Fecha |
||
|
Química |
10°-JT |
¿Por qué no ocurre una reacción química si se ponen en contacto dos sólidos? |
Del 18-08-2020 al 23-08-2020 |
||
|
Objetivo de aprendizaje: Analizar los procesos de transformación de la materia en relación a la ocurrencia de cambios físicos y químicos. |
|||||
|
Evidencias de apredizaje:
|
|||||
Esta guía didáctica es una herramienta diseñada para facilitarte el aprendizaje de nuevos contenidos y el desarrollo o fortalecimiento de tus competencias, de una manera flexible, en cuanto al manejo del tiempo y dinámica de la clase. Esperamos que sea de mucho provecho para el logro de nuestros propósitos formativos.
Pensando en facilitarte las actividades de aprendizaje y la evaluación de tus avances, hemos elaborado este documento conformado por tres componentes o apartados a saber:
1. Orientaciones generales. Apartado en la cual se te brindan indicaciones precisas para el desarrollo exitoso de toda la actividad y los aspectos que se tendrán en cuanta para la evaluación de tus avances.
2. Contenido de la clase. Tema por desarrollar, en el cual se presenta la información básica que te facilitará la construcción de nuevos conceptos y su correlación con otros preexistentes en tu mente.
3. Taller evaluativo. Pon a prueba tus competencias - es la actividad en la que se basará el docente para evaluar algunos avances en los aprendizajes. Deberás resolver la tarea propuesta y enviarla a la dirección de correo electrónico indicada, en el plazo estipulado.
¿Cómo desarrollarás esta guía de actividades?
1. Lee detalladamente el contenido de la clase. Anotando en tu cuaderno las ideas centrales del tema, los conceptos; interpretando cuidadosamente las definiciones o significados de nuevos conceptos y resuelve los ejercicios propuestos orientados a facilitar la compresión del tema “Pon a prueba tus competencias”. Si tienes dudas pide ayuda a un adulto responsable.
2. Estudia con interés los recursos digitales. Videos y consultas recomendadas en la sección “Para saber más sobre el tema”.
3. Resuelve la Actividad. Una vez cumplidos los puntos anteriores podrás resolver los interrogantes planteados a cada una de las lecturas que encontraras en el desarrollo de la clase.
¿Cómo se evaluará la actividad?
|
Enviar la actividad resuelta al correo: edwingutierreziedmagdalena@gmail.com Fecha límite de envío: 23 de agosto de 2020 El proceso para determinar si el estudiante adquirió los conocimientos está direccionado mediante los siguientes parámetros: Participa activamente durante el desarrollo de la actividad. Identifica las características de una reacción química, y los cambios físicos y químicos que ocurren a nivel de la materia. Observa en sus hogares procesos que hacen referencia a cambios físicos y químicos. Registra lo observado y justifica a qué tipo de cambio corresponde.
|
Clase tomada de https://www.colombiaaprende.edu.co/sites/default/files/naspublic/plan_choco/cie_8_b1_s8_est.pdf
Para saber más sobre el tema: https://www.youtube.com/watch?v=6xfW55f9iMY
Introducción
En la figura 1 y 2 se representa el movimiento de las partículas de un gas, al abrir un recipiente y como estas se esparcen y se combinan con las partículas del aire.
En la figura 3 se ilustra la distribución de las moléculas que conforman el dado (un sólido) y como estas no se combinan con el aire.

Reacciones químicas y colisiones entre moléculas
Cuando algunas sustancias se ponen en contacto bajo determinadas condiciones, interactúan dando lugar a nuevas sustancias, se genera un proceso de cambio. (figura 4)
Las sustancias que se transforman se llaman reactivos, y las sustancias resultantes de la transformación se denominan productos.
Una molécula de metano CH4 reacciona con dos moléculas de oxígeno O2, para producir dos moléculas agua 2H2O y una molécula de dióxido de carbono CO2.
Las reacciones químicas no solo se presentan en laboratorios, en la naturaleza la materia está sometida a cambios constantes. Ejemplo de ello son: la formación del agua, la respiración, el ciclo de agua, el ozono presente en la atmósfera, figura 5.



Transformaciones en la naturaleza
Estos cambios o transformaciones de la materia pueden ser físicos o químicos, y dependen si se modifica o no la estructura interna de las sustancias.

En la tabla 1, partiendo de la observación de las imágenes, escribe qué es un cambio físico y químico.


Ecuaciones químicas
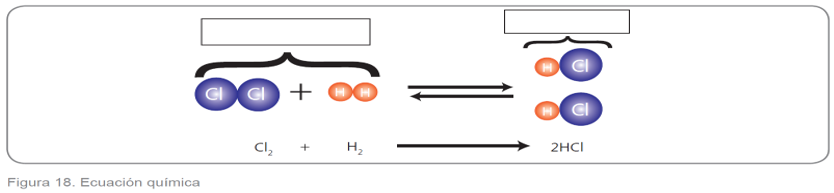
Las reacciones se representan por medio de ecuaciones químicas, esta representación se realiza por medio de fórmulas y símbolos de lo que ocurre en una reacción.
Señala en la figura 18 los componentes que identificas de una ecuación química.
Al leer una ecuación química se debe tener en cuenta que:
Los números ubicados antes de cada fórmula molecular, representan la cantidad de materia expresada en moléculas o moles de cada compuesto (figura 19). Si la expresión es uno no se escribe.

Las ecuaciones químicas deben proporcionar la mayor cantidad posible de información, para ello se utilizan los siguientes símbolos.

La clasificación de las reacciones químicas se determina a partir de las transformaciones que se producen. A continuación se describen siete reacciones.
Reacciones de síntesis o combinación: dos o más sustancias reaccionan para formar una nueva sustancia, presentando una estructura más compleja que los reactivos. La ecuación:
A+B=AB
Pueden presentarse tres tipos de reacciones de síntesis:
• Combinación de dos iones o elementos para formar compuestos
• Combinación entre un ión o un elemento y un compuesto para generar otro compuesto
• Reacción de dos compuestos para formar un nuevo compuesto

Reacciones de desplazamiento: las sustancias involucradas desplazan un ion o átomo de un elemento o compuesto de su posición inicial. Se pueden presentar desplazamiento simple o doble.

Desplazamiento simple: un átomo en estado reacciona con un compuesto, y desplaza un ion o átomo y forman otro compuesto.

Desplazamiento doble: dos compuestos reaccionan formando dos compuestos totalmente nuevos. Por lo general las sustancias reaccionan que están en un medio acuoso. Se dividen las reacciones de desplazamiento doble en:
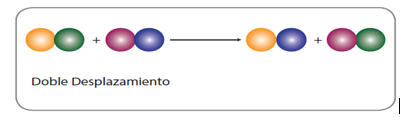
• Reacciones de neutralización: ocurren entre un ácido y una base, produciendo sal y agua.

• Reacciones de precipitación: además del intercambio de átomos o iones las sustancias reaccionantes dan lugar a un precipitado o fase sólida insoluble.

Reacciones de descomposición: los compuestos se descomponen para formar dos o más moléculas. La representación es:
AB = A+B Pueden ser iones, elementos o compuestos.
La descomposición del agua se lleva a cabo a través del proceso de electrólisis, en la cual se requiere aplicar electricidad.

Existe otro tipo de reacción por descomposición térmica, en la cual es necesario aplicar calor
![]()
4. Reacciones exotérmicas: se presenta una liberación de energía en forma de luz, calor o sonido.
La combustión y la fermentación son ejemplos de reacciones exotérmicas.

5. Reacciones endotérmicas: es necesario un aporte constante de energía para romper los enlaces de los reactivos. Un ejemplo de esta reacción es el proceso de la fotosíntesis.
![]()
6. Reacciones de óxido – reducción o redox: Intercambio de electrones entre los reactivos para generar los productos.

La respiración, reacción en una pila y la combustión de hidrocarburos son ejemplos de reacciones redox.


7. Reacciones reversibles e irreversibles: Reacciones reversibles, se presenta cuando los productos se forman el mismo tiempo que los reactivos. Y se utiliza una flecha en un solo sentido.
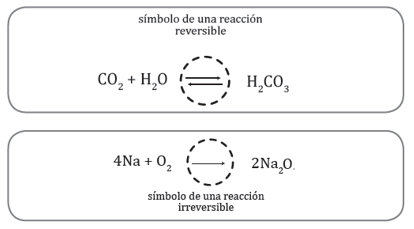
8. Reacciones irreversibles, se producen cuando los reactantes se consumen totalmente hasta convertirse en los productos. Ejemplo la combustión.
Con base en la anterior información, resuelve en tu cuaderno el siguiente crucigrama.

Horizontales
6- Hace referencia al proceso de aplicar electricidad a una reacción
8- Reacción de liberación de energía en forma de luz, calor o sonido
9- La ecuación A+B → AB corresponde a una reacción
Verticales
1- Interpreta los cambios energéticos de las reacciones químicas y se simboliza con la letra H
2- Sustancia que disminuye la energía de activación de una reacción
3- La fermentación y la combustión son ejemplos de reacciones
4- Intercambio de electrones entre los reactivos para formar los productos
5- Reacciones que ocurren entre un ácido y una base, para producir sal y agua
6- La fotosíntesis es un ejemplo de las reacciones
7- Reacción en la que se debe aportar energía constante para romper enlaces de los reactivos
Actividad
Con base en la clase 8, las estudiantes dando clic el siguiente enlace resuelven el cuestionario. Una vez iniciado el desarrollo de la actividad no podrá salir del formulario. Antes de iniciar el desarrollo de la actividad puede tomar apuntes de los conceptos y ejercicios que le faciliten la compresión de los temas. Una vez finalizado el cuestionario dar clic en enviar.
