|
DOCENTE |
Edwin Gutiérrez B |
CORREO |
edwingutierreziedmagdalena@gmail.com |
||
|
ASIGANTURA |
GRADO |
TEMA |
Fecha |
||
|
Química |
10°-JT |
Enlace Químico |
Del 3-08-2020 al 9-08-2020 |
||
|
Objetivo de aprendizaje: Explicar la formación de enlaces químicos a partir del comportamiento de los electrones en la capa de valencia. |
|||||
|
En esta actividad esperamos que:
|
|||||
Descripción de la guía.
Esta guía didáctica es una herramienta diseñada para facilitarte el aprendizaje de nuevos contenidos y el desarrollo o fortalecimiento de tus competencias, de una manera flexible, en cuanto al manejo del tiempo y dinámica de la clase. Esperamos que sea de mucho provecho para el logro de nuestros propósitos formativos.
Pensando en facilitarte las actividades de aprendizaje y la evaluación de tus avances, hemos elaborado este documento conformado por tres componentes o apartados a saber:
- Orientaciones generales. Apartado en la cual se te brindan indicaciones precisas para el desarrollo exitoso de toda la actividad y los aspectos que se tendrán en cuanta para la evaluación de tus avances.
- Contenido de la clase. Tema por desarrollar, en el cual se presenta la información básica que te facilitará la construcción de nuevos conceptos y su correlación con otros preexistentes en tu mente.
- Taller evaluativo. Pon a prueba tus competencias - es la actividad en la que se basará el docente para evaluar algunos avances en los aprendizajes. Deberás resolver la tarea propuesta y enviarla a la dirección de correo electrónico indicada, en el plazo estipulado.
¿Cómo desarrollarás esta guía de actividades?
- Lee detalladamente el contenido de la clase. Anotando en tu cuaderno las ideas centrales del tema, los conceptos; interpretando cuidadosamente las definiciones o significados de nuevos conceptos y resuelve los ejercicios propuestos orientados a facilitar la compresión del tema “Pon a prueba tus competencias”. Si tienes dudas pide ayuda a un adulto responsable.
- Estudia con interés los recursos digitales. Videos y consultas recomendadas en la sección “Para saber más sobre el tema”.
- Resuelve la Actividad. Una vez cumplidos los puntos anteriores podrás resolver los interrogantes planteados a cada una de las lecturas que encontraras en el desarrollo de la clase. Al llegar a este momento ya estaras lista para resolver el cuestionario que aparece en la parte inferior de la clase, para acceder al este deberas dar clic en el enlace.
¿Cómo se evaluará la actividad?
|
Enviar la actividad resuelta al correo: edwingutierreziedmagdalena@gmail.com Fecha límite de envío: 09 de agosto de 2020 El proceso para determinar si el estudiante adquirió los conocimientos está direccionado mediante los siguientes parámetros: Participa activamente durante el desarrollo de la actividad. Comprende las relaciones entre la configuración electrónica; estructura de Lewis, y reactividad de algunos elementos. Clasifica los compuestos químicos en átomos, moléculas e iones. Representa diferentes tipos de enlaces químicos mediante el uso de las estructuras de Lewis. Establece la importancia y uso de los enlaces químicos sus fuerzas en la conformación de diversos compuestos químicos. |
Clase tomada de https://www.colombiaaprende.edu.co/sites/default/files/naspublic/plan_choco/cie_8_b1_s8_est.pdf
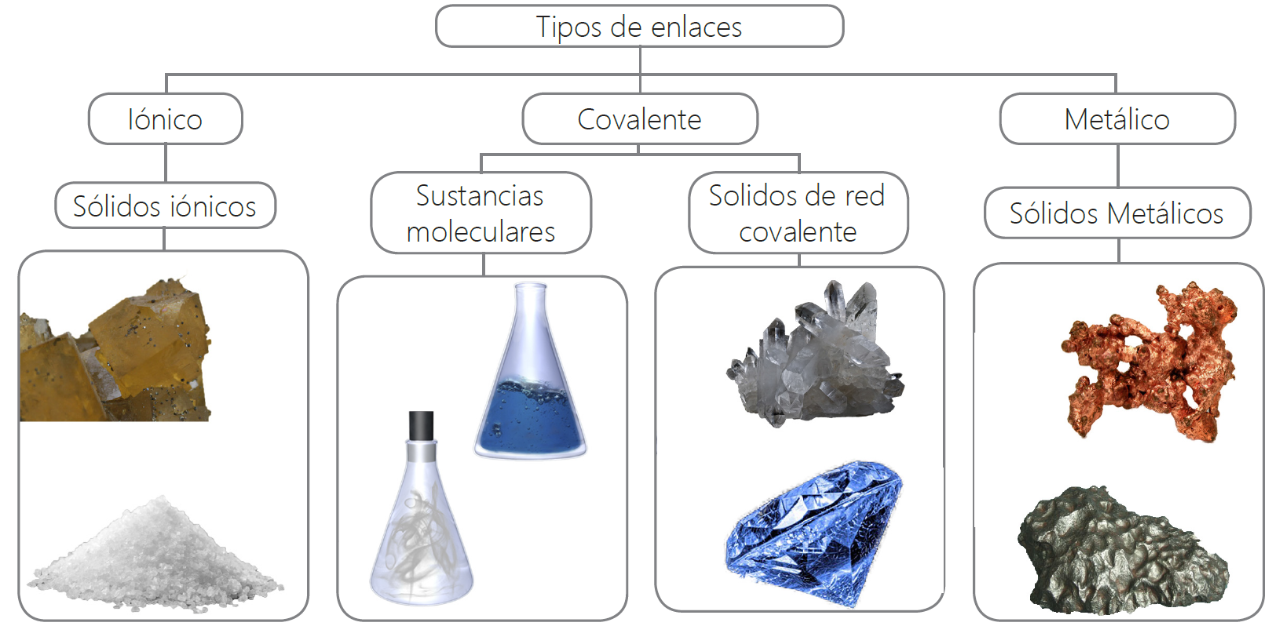
Lea el siguiente texto.
Lectura 1
Enlace químico
A excepción de casos muy raros, la materia no se desintegra espontáneamente. La desintegración se evita por las fuerzas que actúan a nivel iónico y molecular. A través de las reacciones químicas, los átomos tienden a llegar a estados más estables con menores niveles de energía potencial química.
Como ya se sabe, cuando dos o más átomos se unen, forman una molécula. Esta puede estar constituida por átomos de un mismo elemento o por átomos de elementos diferentes. Surge entonces la pregunta:
¿cómo se mantienen unidos los átomos? La respuesta la dan los enlaces químicos.
Un enlace químico es el resultado de la fuerza de atracción que mantiene unidos los átomos para formar moléculas. Los electrones que intervienen en el enlace son los que están ubicados en el último nivel de energía, el nivel de valencia; estos electrones pueden pasar de un átomo a otro para completar el número de electrones del último nivel y así estabilizar electrónicamente el átomo.
Los átomos pueden utilizar dos mecanismos para formar enlaces químicos, dependiendo del número de electrones de valencia que poseen. Estos mecanismos son en primer lugar, de transferencia de electrones que se presenta cuando un átomo transfiere sus electrones a otro átomo permitiéndole que complete ocho en su último nivel de energía y, en segundo lugar, compartimiento de electrones que se presenta cuando dos átomos comparten uno o más electrones de valencia y así ambos completar ocho electrones de valencia.
Tomado y adaptado de: Cabrera B, Clavijo M, Samacá N. (1999). Guía de recursos Ciencias Naturales 7, Bogotá, Colombia: Santillana.
Con base en la lectura 1, responda las siguientes preguntas en tu cuaderno:
a) ¿Qué tipos de mecanismo existen para formar enlaces químicos?
b) ¿Cuáles son los electrones que participan en un enlace químico?
c) ¿Dónde se ubican los electrones que aparecen en un enlace químico?
Lea el siguiente texto.
Lectura 2
Enlace iónico
Cuando un átomo cede un electrón, el número de protones será mayor que el número de electrones y se generará una carga positiva (+) en el átomo, pero si gana un electrón el número de protones será menor que el número de electrones y se generará una carga negativa (-); en ambos casos se habrán formado iones. La carga del ion dependerá del número de iones cedidos o ganados; si un átomo gana dos electrones tendrá dos cargas negativas; si pierde dos electrones tendrá dos cargas positivas. Estos iones tienen cargas eléctricamente contrarias por lo cual pueden atraerse mutuamente y formar un enlace iónico, dando lugar a un compuesto iónico.
El enlace químico iónico se forma por transferencia de uno o más electrones de un átomo o grupo de átomos a otro. Por lo general, la unión de un elemento metálico con un no metal es de tipo iónico.
Tomado y adaptado de: Cabrera B, Clavijo M, Samacá N. (1999). Guía de recursos Ciencias Naturales 7, Bogotá, Colombia: Santillana.
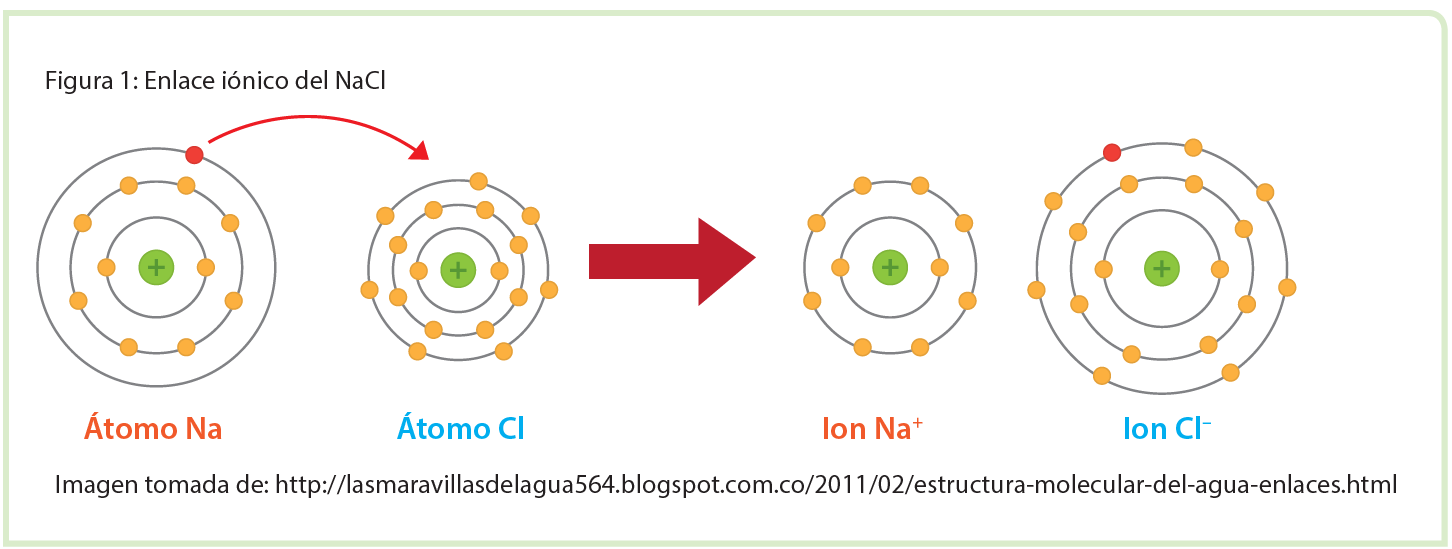
Con base en la Figura 1, responda las siguientes preguntas en su cuaderno.
a) ¿Qué átomo cede el electrón?
b) ¿Qué átomo gana el electrón?
c) Escriba la configuración electrónica del ión sodio y del ión cloro.
d) Explique la formación del enlace de AlCl3 en forma de estructura de Lewis.
Lea el siguiente texto.
Lectura 3
Enlace covalente
No todos los átomos ceden o ganan electrones cuando forman enlaces. Un enlace covalente se forma cuando dos átomos comparten uno o más de dos pares de electrones para completar cada uno ocho electrones en su último nivel. En este enlace, no hay formación de iones y se presenta principalmente entre los no metales. Los electrones compartidos en un enlace covalente pertenecen a ambos átomos.
Cada par de electrones compartidos se representa por una línea que une los dos símbolos de átomos. Ejemplo: la molécula de agua está formada por dos átomos de hidrógeno y uno de oxígeno (no metales).
Tomado y adaptado de: Cabrera B, Clavijo M, Samacá N. (1999). Guía de recursos Ciencias Naturales 7, Bogotá, Colombia: Santillana.
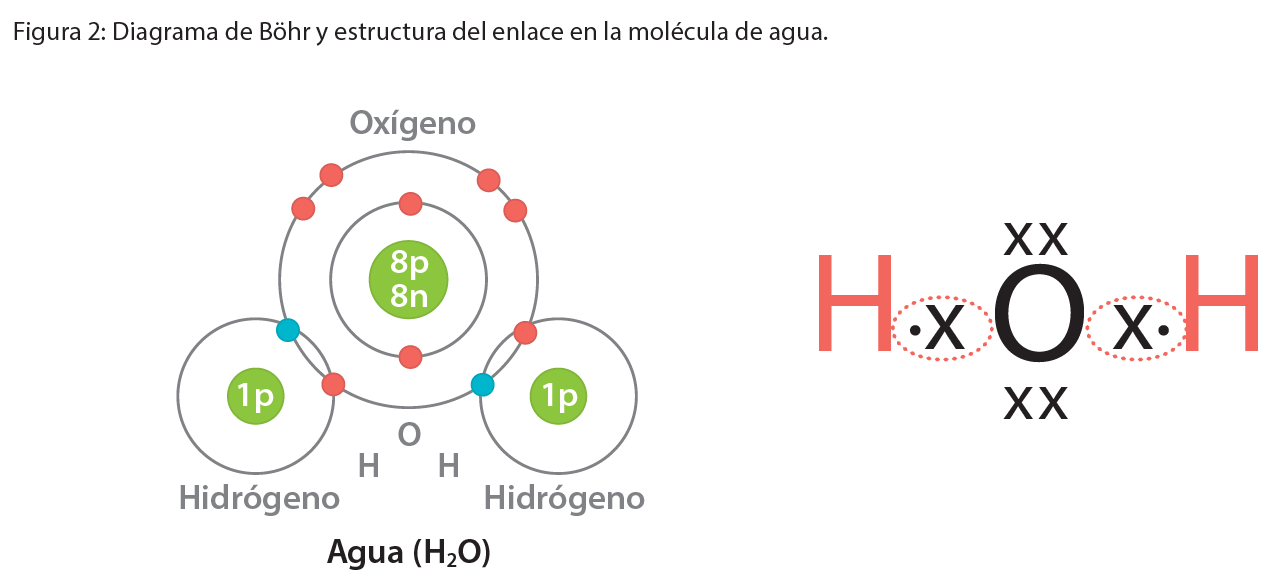
Con base en la lectura 3, responda en su cuaderno las siguientes preguntas:
a) ¿Cuántos electrones forman un enlace covalente?
b) ¿Un enlace covalente se forma entre átomos de elementos metálicos o no metálicos?
c) ¿Cuál es la configuración electrónica del hidrógeno y del cloro? ¿Cuántos electrones de valencia tiene
cada uno?
d) Dibuje la estructura de Lewis del enlace covalente que hay en HCl.
Lea el siguiente texto.
Lectura 4
Clases de enlaces covalentes
Dependiendo del número de enlaces compartidos, los enlaces covalentes pueden ser simples o sencillos, dobles o triples.
Enlace covalente sencillo: es el que se forma cuando los átomos que se unen comparten un par de electrones; cada átomo aporta un electrón, como en el caso del HCl.
Enlace covalente doble: es el que se forma cuando los átomos que se unen comparten dos pares de electrones; cada átomo aporta un par. Se representa con dos líneas cortas (=).
Ejemplo: la molécula de oxígeno
Figura 3. Enlace covalente
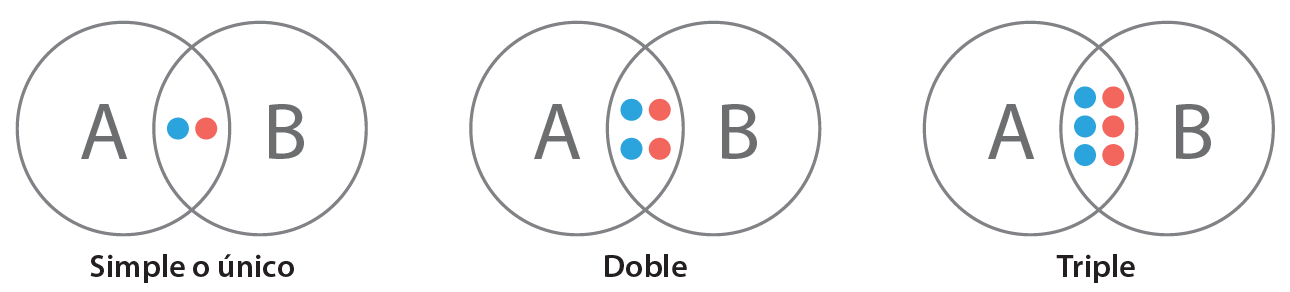
Enlace covalente triple: es el que se forma cuando se comparten tres pares de electrones; cada átomo aporta tres electrones. Su representación es de tres líneas (≡).
Ejemplo: la molécula del nitrógeno.
También los enlaces covalentes se diferencian en polar y apolar dependiendo de la electronegatividad de cada átomo.
Enlace covalente apolar: cuando las moléculas están formadas por dos átomos iguales, estas no presentan diferencia en la electronegatividad, por lo cual son conocidas como moléculas apolares (sin polos). Los pares de electrones compartidos son atraídos por ambos núcleos con la misma intensidad. También se da el enlace apolar cuando la diferencia de electronegatividad es inferior a 0,5.
Figura 4.
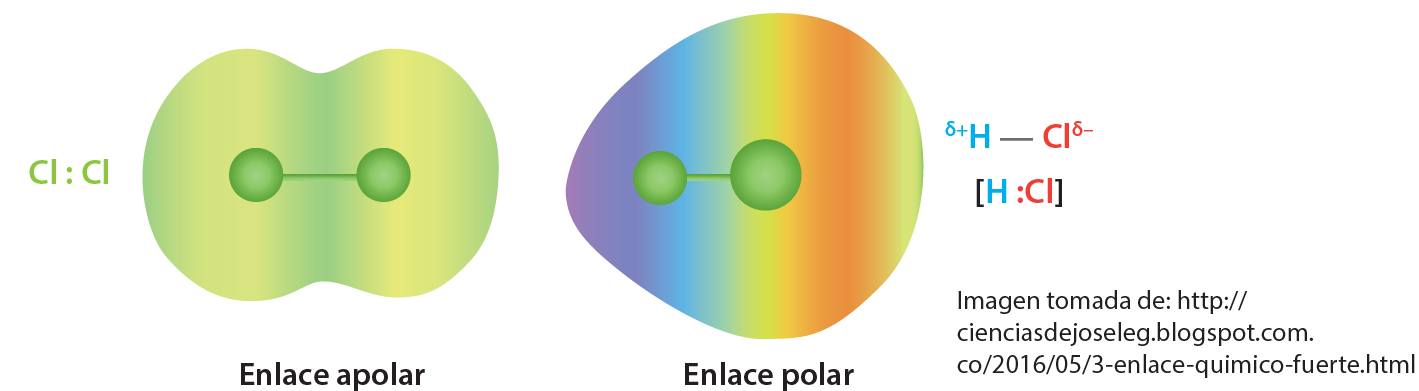
Enlace covalente polar: cuando los átomos se enlazan, tienen una electronegatividad diferente. En la molécula se establece una zona donde se concentra una mayor densidad electrónica, originándose así un polo positivo y uno negativo. Por consiguiente, la zona que pertenece al átomo de mayor electronegatividad, será el polo negativo y la de menor electronegatividad, será la del polo positivo. La diferencia de electronegatividad entre los dos átomos de diferentes elementos del enlace polar debe ser entre 0,5 y 1,6 superior a este valor es un enlace iónico. En la figura se indican las cargas parciales (positiva y negativa) mas no se representa la carga de cada ion. HCl → H + δ----Cl – δ
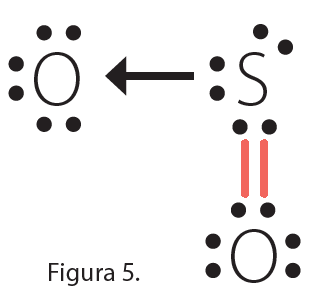
Enlace covalente coordinado: este enlace tiene lugar entre distintos átomos y se caracteriza porque los electrones que se comparten son aportados por uno solo de los átomos que se enlazan. El átomo que aporta el par de electrones se denomina dador y el que lo recibe, receptor.
El enlace covalente coordinado se representa por medio de una flecha que parte del átomo que aporta los dos electrones y se dirige hacia el átomo que no aporta ninguno. El SO2 es una molécula en la cual se presenta un enlace covalente doble y dativo.
Tomado y adaptado de: Cabrera B, Clavijo M, Samacá N. (1999). Guía de recursos Ciencias Naturales 7, Bogotá, Colombia: Santillana.
Mondragón, C., Peña, L., Sánchez, M., Arbelaéz, F., & González, D. (2010). Hipertexto Química 1. Bogotá, Colombia: Santillana.
· Para saber más sobre el tema: https://www.youtube.com/watch?v=FJu9WkFyiaQ
Con base en la lectura 4. En su cuaderno señale el compuesto que solo posee enlace covalente.
a) KCl b) BaCO3 c) H2SO4 d) KNO2 e) BaO
Indique qué tipo de molécula se presenta de acuerdo con el tipo de enlace.
a) H2
b) Cl2
c) O2
d) N2
e) F2
f) CO2
g) H2O
h) HNO2
i) HCl
j) CO
Actividad
Con base en la clase 7, las estudiantes dando clic el siguiente enlace resuelven el cuestionario. Una vez iniciado el desarrollo de la actividad no podrá salir del formulario. Antes de iniciar el desarrollo de la actividad puede tomar apuntes de los conceptos y ejercicios que le faciliten la compresión de los temas. Una vez finalizado el cuestionario dar clic en enviar.
docs.google.com/forms/d/1Blh8HpMXjpXJKhhDNDkzk6LWNtR1m3M9kwDt_0xogFQ/edit
